【中心科研】Molecular Psychiatry丨中山三院脑病团队揭示ClC-2致髓鞘病变机制,为白质脑病治疗提供潜在靶点
近日,我院脑病团队在国际知名期刊Molecular Psychiatry(神经科学、精神病学、生化与分子生物学均属一区,Top期刊)发表了题为“Targeting astrocytic CLC2 (CLCN2) restores myelin regeneration through inhibition of SPP1/CD44 signaling pathway in leukoencephalopathy” 的研究论文。中山大学附属第三医院脑病中心博士研究生杨露为第一作者,彭福华教授、汤常永副研究员、邱伟教授为共同通讯作者。

原文链接 https://www.nature.com/articles/s41380-025-03159-x
研究背景
白质脑病是一类以脑白质内髓鞘或胶质细胞受累为主要特征的疾病,包括遗传性、获得性及其他不明原因引起的白质脑病。尽管目前对多种获得性白质脑病如多发性硬化(Multiple sclerosis,MS)、视神经脊髓炎谱系疾病(Neuromyelitis optica spectrum disorders,NMOSDs)等的了解和研究已经比较全面且深入,但对于各类遗传性白质脑病的认识还比较局限。CLCN2相关白质脑病(Chloride voltage-gated channel 2 related leukoencephalopathy,CC2L)是一种由CLCN2基因突变致其编码的电压门控氯离子通道(Chloride voltage-gated channel 2,ClC-2)异常而引起的白质脑病,临床表现为缓慢发展的共济失调及认知功能下降,部分伴有视力减退。然而,受限于CC2L罕见病例的散在分布、且缺乏理想的动物模型,目前中枢神经系统内ClC-2结构或功能异常与髓鞘病变的关系及其具体作用机制仍未明确。因此,该研究探讨了ClC-2在少突胶质细胞发育及髓鞘修复中的作用,及其致髓鞘病变的具体作用机制,并通过对该机制的全面探讨与阐释,筛选了可能的干预靶点作为CC2L及其他类似的白质脑病的潜在治疗策略。
关键发现
1. 星形胶质细胞中的ClC-2影响少突胶质前体细胞的增殖与分化。
通过转染携载shCLCN2的慢病毒(Lenti-shCLCN2)降低小鼠原代星形胶质细胞上的CLCN2表达,并将其与少突胶质前体细胞共培养,可显著抑制后者的增殖与分化效率。团队随后构建了人多能诱导干细胞(hiPSCs)来源的星形胶质细胞(iASTs),通过shCLCN2转染降低其CLCN2表达,发现CLCN2下调的iASTs来源的条件培养基同样显著抑制了少突胶质前体细胞的增殖与分化。
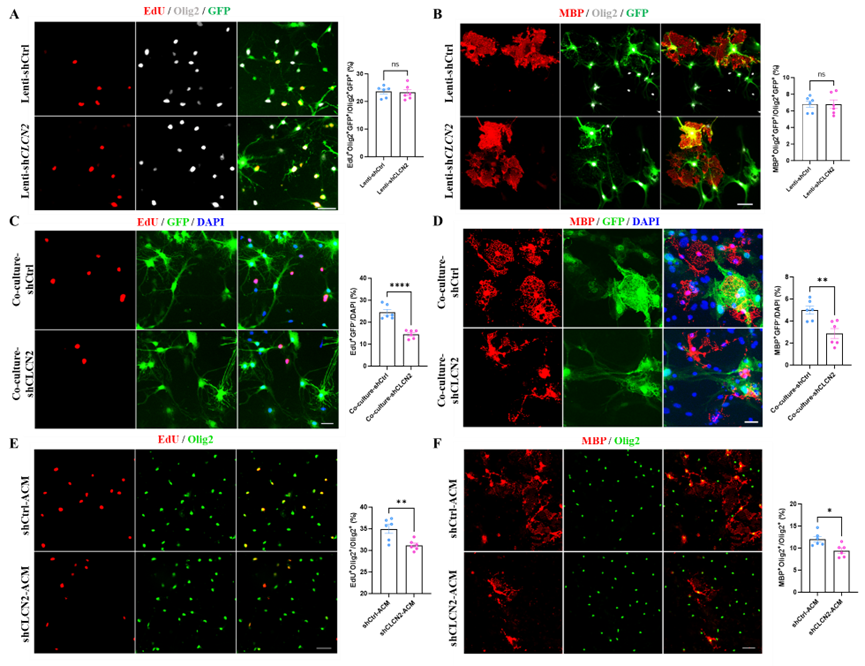
图1. 星形胶质细胞中ClC-2对少突胶质前体细胞增殖、分化的影响
2. 星形胶质细胞中的ClC-2影响髓鞘修复及白质功能
为明确星形胶质细胞中的ClC-2在髓鞘发育、修复及白质功能中的作用,团队构建了星形胶质细胞特异性CLCN2基因敲除鼠(CLCN2flox/flox; ALDH1L1-CreERT, 后续记为CLCN2f/f cKO ),结果显示,CLCN2敲除可显著影响少突胶质谱系细胞的增殖、分化效率及髓鞘结构,并影响了脱髓鞘CLCN2f/f cKO 小鼠的认知功能。
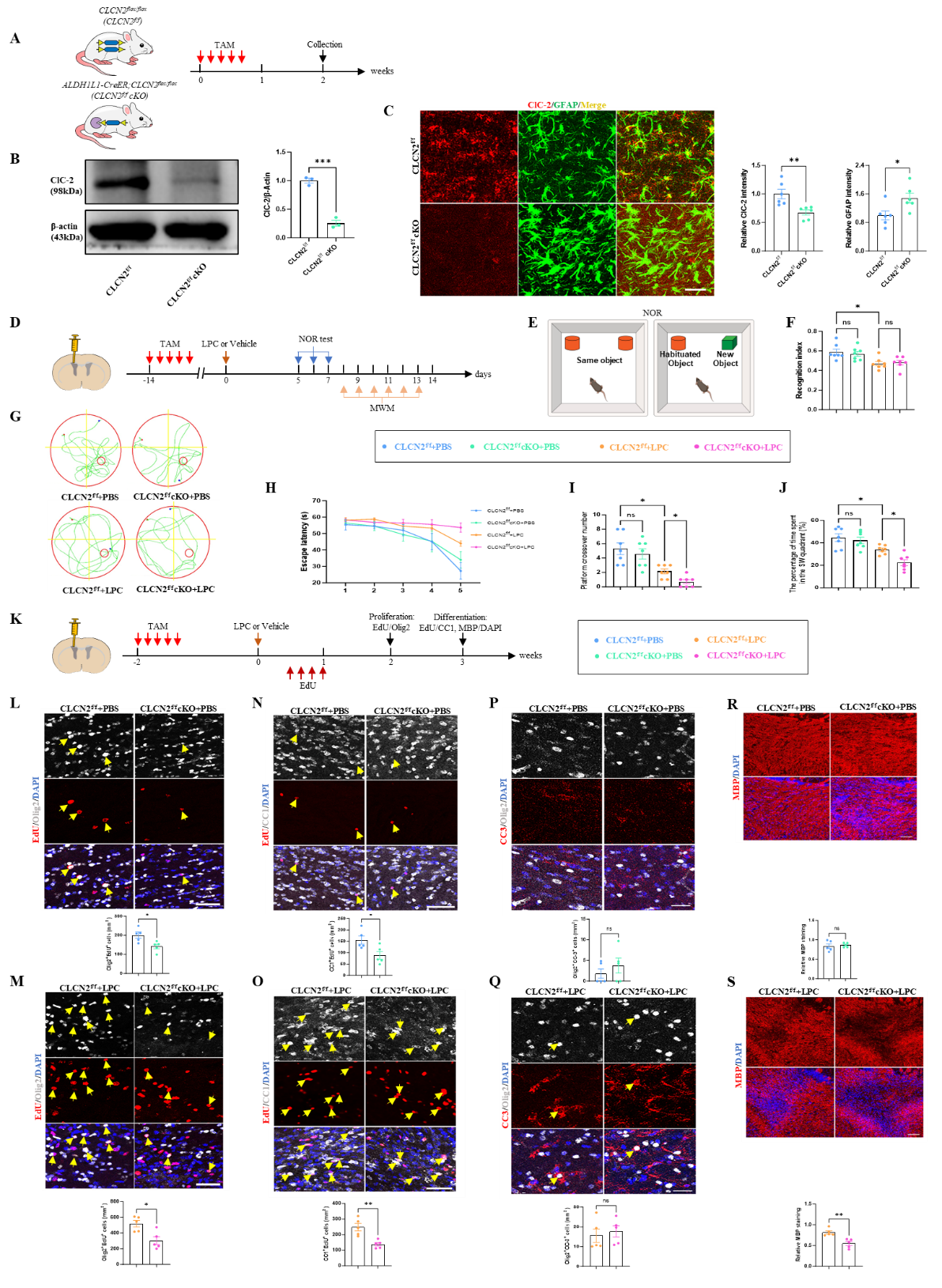
图2. 星形胶质细胞特异性CLCN2敲除在髓鞘再生和白质功能中的作用
3. ClC-2异常星形胶质细胞影响少突胶质谱系细胞发育和髓鞘再生的机制
该研究通过转录组学及蛋白质谱测序,发现CLCN2表达降低的iASTs出现显著基因表达变化。基于少突胶质前体细胞及器官型脑片的体外培养模型,团队明确了过量的星形胶质细胞来源的分泌型磷蛋白1(Secreted phosphoprotein 1,SPP1)是影响少突胶质前体细胞增殖与分化的关键蛋白,并影响脱髓鞘后的髓鞘修复。随后,通过靶向降低CLCN2f/f cKO小鼠中异常表达的SPP1,并诱导局部脱髓鞘,结果提示靶向下调SPP1可明显恢复CLCN2f/f cKO小鼠脱髓鞘后的少突胶质谱系细胞募集及髓鞘再生能力,并相应地改善其认知功能。进一步通过基因表达调控或药理拮抗SPP1的下游受体CD44,可对少突胶质谱系细胞募集及髓鞘再生能力起到类似的改善作用。这表明,异常高表达SPP1是由星形胶质细胞中CLCN2的变化导致,并通过作用于少突胶质前体细胞上的CD44受体影响其正常功能及髓鞘结构的维持。
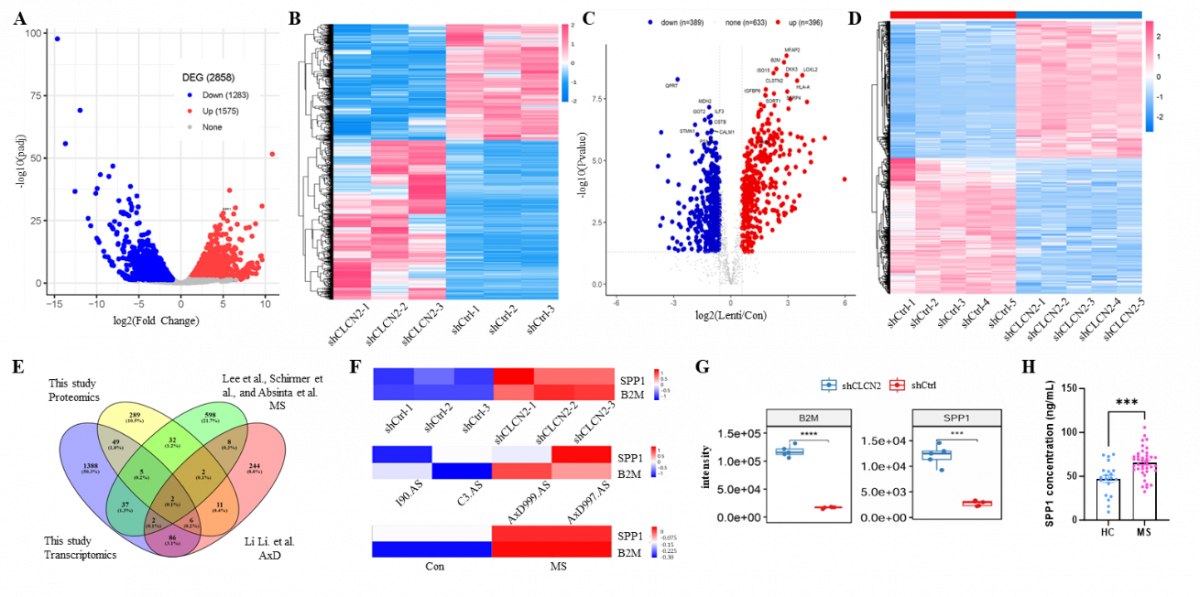
图3. 转录组学测序及蛋白质谱测序
4. CC2L-iPSCs来源的星形胶质细胞对少突胶质谱系细胞发育的影响
为明确CC2L相关髓鞘病变的具体作用机制,团队将CC2L患者尿液上皮细胞诱导为iPSCs(CC2L-iPSCs),并将其进一步诱导分化为iASTs。结果显示,CC2L-iPSCs来源的iASTs同样出现了异常的SPP1表达上调,CC2L-iASTs来源的条件培养基显著抑制了少突胶质前体细胞的增殖与分化。而下调CC2L-iASTs中SPP1的异常表达可有效减弱其对少突胶质前体细胞增殖与分化功能的抑制,这表明SPP1异常表达可能是引起CC2L相关髓鞘病变的重要原因,靶向SPP1或其下游受体的干预措施可改善CC2L相关少突胶质谱系细胞发育障碍,并可能作为改善CC2L相关白质病变的有效治疗手段。
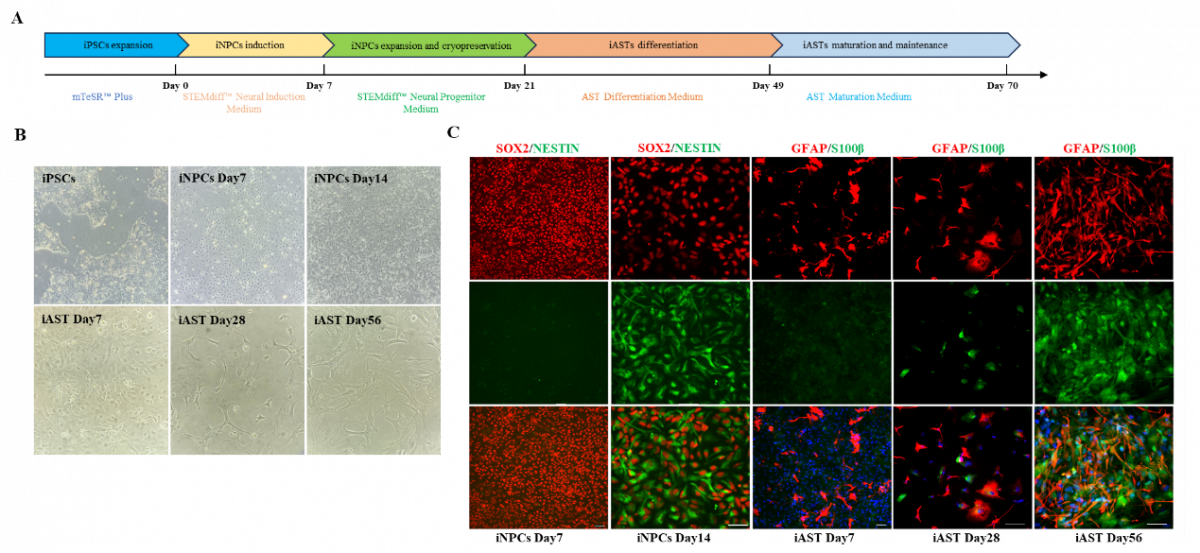
图4. 人诱导多能干细胞来源的星形胶质细胞分化体系
研究意义
该研究全面探讨了星形胶质细胞ClC-2参与少突胶质谱系细胞发育及髓鞘修复的机制,及其在ClC-2相关髓鞘病变与多种不同白质脑病中存在的普适规律。通过CC2L-患者特异的iPSC明确了相应机制在CC2L致病中的作用,为CC2L及类似白质脑病的机制研究和靶向干预治疗提供了实验依据。









